Agência só vai aceitar solicitação de empresas que já estiverem testando suas vacinas em voluntários no Brasil. Vacina com uso emergencial pode ter uso suspenso a qualquer momento pela Anvisa e seu uso é restrito ao SUS.
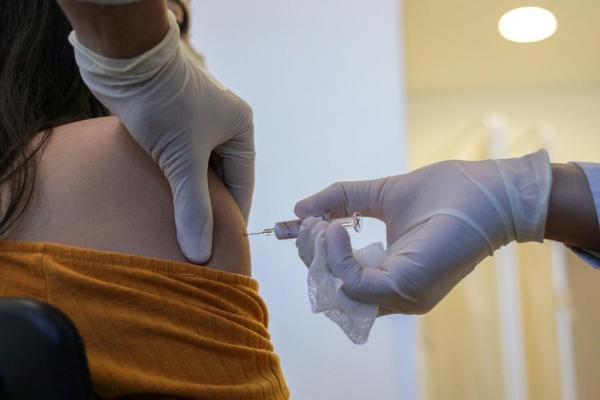
Aplicação da primeira dose da vacina Coronovac no Hospital das Clínicas de São Paulo – Foto: Divulgação/Governo de São Paulo
A Agência Nacional de Vigilância Sanitária (Anvisa) divulgou nesta quarta-feira (2) que vai aceitar que empresas desenvolvedoras de vacinas contra a Covid-19 solicitem o uso emergencial no Brasil.
O uso será restrito a vacinas que estejam em testes no Brasil. O uso emergencial da vacina é diferente do registro sanitário, que é a aprovação completa para o uso da vacina. Esse registro definitivo depende de mais dados e da conclusão de todas as etapas de teste da vacina.
De acordo com a Anvisa, o uso emergencial do produto será liberado apenas o público previamente definido e testado nos estudos. A agência destacou que a autorização não irá substituir o registro sanitário no Brasil, que será exigido para a ampliação do imunizante a toda a população.
Quatro vacinas estão na fase 3 de testes em humanos no Brasil. Caso os imunizantes estejam encaixados nos critérios, poderão solicitar o uso emergencial.
São elas:
• AstraZeneca + Universidade de Oxford: 70% de eficácia, com uma variação de 62% a 90% de acordo com a dose aplicada.
• CoronaVac: ainda sem a taxa de eficácia divulgada.
• Pfizer + BioNTech: 95% de eficácia e mais de 94% eficaz em idosos acima de 65 anos, segundo dados preliminares da fase 3.
• Janssen: ainda sem a taxa de eficácia divulgada.
Principais pontos do "uso emergencial":
• Cada pedido deve ser feito pela empresa desenvolvedora e será analisado de forma independente;
• Decisão será tomada pela Diretoria Colegiada da Anvisa;
• Serão considerados estudos não-clínicos e clínicos (em humanos);
• Serão itens avaliados: qualidade, boas práticas de fabricação, estratégias de monitoramento e controle, e resultados provisórios de ensaios clínicos;
• Empresa interessada deverá comprovar que a fabricação e a estabilidade do produto garantem a qualidade da vacina;
• Estudo clínico na fase 3 – última etapa de testes – deve estar em andamento e conduzido também no Brasil;
• Vacina com uso emergencial liberado não pode ser comercializada, ela só pode ser distribuída no sistema público de saúde;
• Liberação de uso emergencial pode ser revogada pela Anvisa a qualquer momento.
FONTE: G1
